全球好药资讯|Rybrevant(JNJ-6372)治疗METex14突变肺癌患者临床数据
在大约3%的NSCLC患者中发现METex14突变 。 这些基因改变导致MET受体过度激活 , 并导致相应的癌细胞生长 。 并且 , 绝大多数患者开始发展出对MET酪氨酸激酶抑制剂(TKI)疗法的耐药性 , 因此需要新的治疗选择 。
Rybrevant是首个针对EGFR和MET的双特异性抗体 。 2021年5月21日获得FDA批准 , 用于EGFR 20外显子插入突变NSCLC成人患者的一线治疗 。
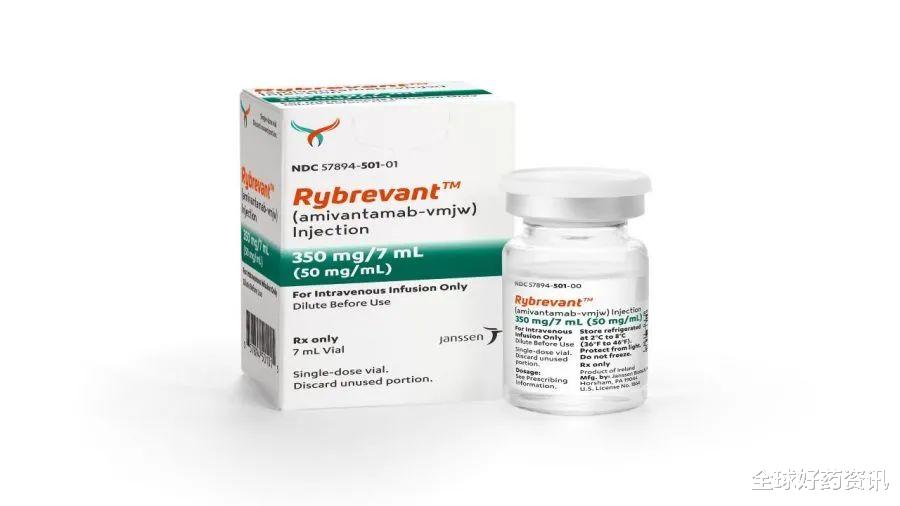
商品名:Rybrevant
【全球好药资讯|Rybrevant(JNJ-6372)治疗METex14突变肺癌患者临床数据】通用名:amivantamab-vmjw
代号:JNJ-6372/JNJ-61186372
靶点:EGFR
美国首次获批:2021年5月
中国首次获批:尚未获批
获批适应症:铂类化疗后进展的EGFR外显子20插入突变(EGFR20ins)的转移性非小细胞肺癌(NSCLC)患者 。
推荐剂量:体重<80kg的患者接受1050 mg剂量;体重≥80 kg患者的剂量为1400 mg 。
单药治疗临床数据CHRYSALIS(NCT02609776)是一项I期开放标签、多中心、首个在人体内进行的研究 , 旨在评估Rybrevant作为单药疗法以及与Lazertinib(一种新型第三代EGFR TKI)联合治疗的安全性、药代动力学和初步疗效 。 该研究包括两部分:Rybrevant单药治疗和联合剂量递增;Rybrevant单药治疗和联合剂量扩大 。
在CHRYSALIS试验的METex14队列中 , 19例具有METex14突变的NSCLC患者接受了Rybrevant治疗【1050 mg(对于体重 <80 kg 的患者)或 1400 mg(对于体重≥ 80 kg 的患者)】 。
该研究的主要终点是根据RECIST v1.1标准评估的客观缓解率(ORR) 。
研究数据显示 , 在 14 例可评估疗效的患者中 , 64%的患者观察到部分缓解(PR) 。 此外 , 在未接受过治疗和先前接受过治疗的患者中均观察到抗肿瘤活性 , 包括4例先前接受过 MET 酪氨酸激酶抑制剂(TKI)的患者 。 首次反应的中位时间为4.1个月(范围为1.6-9.9) 。
大多数治疗相关不良事件(AEs)为1~2级 , 3例患者(16%)观察到治疗相关不良事件≥3级 , 包括呼吸困难(1例)、低白蛋白血症(1例)和皮疹(1例) 。
与治疗相关的AEs导致剂量减少和停药的发生率分别为11%和5% , 32%的患者出现剂量中断 。
Rybrevant联合Lazertinib治疗数据2021年7月31日 , 《OncLive》公布了Rybrevant联合Lazertinib治疗奥希替尼耐药且未经化疗的EGFRDel 19 或L858R 突变NSCLC 患者(n=45例)的安全性和有效性 。
研究数据显示 , 该人群中使用Amivantamab联合Lazertinib组获得的客观缓解率(ORR)为36%;中位持续反应时间(DOR)为9.6个月;临床获益率(CBR)为64%;中位无进展生存期(PFS)为4.9个月 。
此外 , 在17例EGFR或MET信号通路为主的耐药机制的患者中 , Amivantamab联合Lazertinib组的 ORR为47%;中位DOR为10.4个月;CBR为82%;中位PFS为6.7个月 。
在28例其它耐药机制的患者中 , ORR为29% , 中位DOR为8.3个月 , CBR为54% , 中位PFS为4.1个月 。
值得注意的是 , Amivantamab联合Lazertinib治疗组未观察到新的安全信号 , 且最常见的不良反应包括输液相关反应(78%)、痤疮样皮炎(51%)、皮疹(27%)和甲癣(49%) 。 然而 , 大多数不良反应是1级或2级 。
结论这项试验获得的数据显示Rybrevant的双特异性作用机制可以提供针对 EGFR 突变或 MET 突变的非小细胞肺癌的抗肿瘤活性 。
经验总结扩展阅读
- 全球真珠美学珍珠发酵精华水,邂逅肌肤好状态
- 光伏 全球光伏组件厂商十强:中国企业占7席,美国仅有1家
- 扎心 保湿精华液有什么作用 全球畅销的保湿精华液安利
- 消息资讯选不到合适的隔离霜怎么办?试试隔离精华吧!|CB拍拍隔离精华液
- 消息资讯2020隔离霜十大排行榜新鲜出炉,看看哪款是你的最爱
- 兰博基尼 全球经济下行,为什么兰博基尼卖得更好了?
- 爽肤水 护肤水乳哪个牌子好 全球爽肤水品牌排行榜10强
- 制造业 全球服装业“隐形冠军”:这家中国宁波企业,市值超2200亿
- 全球最美的峡谷在中国!完爆美国大峡谷!
- 俩中国老头,轰动了全世界,感动了全球无数人!