印塔健康|“不限癌种”,持续缓解近3年!Jemperli新适应症获FDA加速批准
文章图片

文章图片

此前 , 2021年4月23日 , 美FDA批准了Jemperli单药用于治疗接受含铂化疗期间或之后病情进展的dMMR复发性或晚期子宫内膜癌患者 。
Jemperli是一款人源化抗PD-1单克隆抗体 , 与PD-1受体结合 , 并阻断其与配体PD-L1和PD-L2的相互作用 。 该药通过靶向PD-1/PD-L1(存在于人体免疫细胞和一些癌细胞上的蛋白质)的细胞途径发挥作用 。 Jemperli通过阻断这一途径帮助人体免疫系统对抗癌细胞 。
商品名:Jemperli
通用名:Dostarlimab-gxly
代号:TSR-042
靶点:PD-1
美国首次获批:2021年4月
中国首次获批:未获批
【印塔健康|“不限癌种”,持续缓解近3年!Jemperli新适应症获FDA加速批准】获批适应症:子宫内膜癌、实体瘤
推荐剂量:第1-4剂用药为500mg、每3周一次 。 从第4剂后3周开始的后续给药(从第5剂开始):1600mg、每6周一次 。 通过静脉输液给药 , 输注时间大于30分钟 。
临床数据此次加速批准是基于一项非随机、多中心、开放标签、多队列的GARNET试验(NCT02715284)的临床结果 。 有效人群包括209例dMMR复发或晚期实体瘤患者 , 他们在全身治疗后进展 , 没有令人满意的替代治疗方案 。 dMMR子宫内膜癌患者必须在含铂方案治疗期间或之后进展 。 dMMR结直肠癌患者必须在氟嘧啶、奥沙利铂和伊立替康治疗后进展或不耐受 。
入组患者的人群特征包括:77%的患者为女性;中位年龄63岁;63%的患者为白人 , 3%的患者为亚洲人 , 2%的患者为黑人;ECOG评分为0(39%)或1(61%) 。
在试验开始时 , 97.2%的非子宫内膜dMMR实性肿瘤患者为IV期;68.0%的dMMR子宫内膜肿瘤患者为FIGO IV期 。
约43%的患者既往接受过1线全身性抗癌治疗 , 36%的患者既往接受过2线全身性治疗 , 21%的患者既往接受过≥3线全身性治疗 。
根据RECIST v 1.1标准 , 主要疗效结果衡量指标为客观缓解率(ORR)和缓解持续时间(DOR) 。
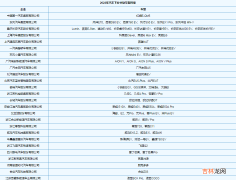
试验结果显示 , 在所有dMMR实体瘤患者中 , Jemperli的客观缓解率(ORR)为41.6% , 完全缓解(CR)率为9.1% , 部分缓解(PR)率为32.5% 。 中位缓解持续时间(DOR)为34.7个月 , 95.4%患者缓解持续时间≥6个月 。
图注:Jemperli治疗错配修复缺陷复发或晚期实体瘤患者的临床数据
在103例子宫内膜癌(EC)患者中 , ORR为44.7% , DOR的范围为2.6个月到35.8+个月 。
在106例非子宫内膜癌(non-EC)患者中 , 总的ORR为38.7% , DOR的范围为5.6个月到30.1+个月 。
具体各癌种疗效数据如下:
在69例结直肠癌(CRC)患者中 , ORR为36.2% , DOR的范围为5.6个月到30.1+个月;
在12例小肠肿瘤患者中 , ORR为33.3% , DOR的范围为11.1+个月到28+个月;
在8例胃癌患者中 , ORR为37.5% , DOR的范围为8.4+个月到17.5个月;
2例结胆管癌患者均达到CR , DOR的范围为8.4+个月到13.5+个月;
经验总结扩展阅读
- 什么家有柯基:柯基幼犬可以吃什么 小柯基吃什么又营养又健康?
- 女神“宽胯”的鲨鱼裤美女,擅长打造优雅靓丽风,魅力无穷
- 女神苏提达是冻龄女神,“花仙子”造型美出圈,高颜值碾压茜茜公主
- 下巴伊人小课堂 | 护肤:人人都有的“面霜”,怎么用才有效?
- 林庆昆|《完美伴侣》“离婚了,我就没有家了!”林庆坤为何是这个反应?
- 方法去角质有哪些方法,需要注意什么
- 穿衣搭配 辛芷蕾“野味儿”发型太阴森、好诡异?剪成高晓松真的只怪你。
- 穿衣搭配 迪丽热巴高马尾+西装杀,可御可甜!网友大呼“迪总娶我!”
- 进行悄悄告诉女人:护肤牢记4个“秘诀”,四十岁看起来也很年轻
- 棕色童瑶的私服搭配挺“普通”,棕色大衣配贝雷帽简约大气,挺显气质